Знаменитое стихотворение Сэмюэля Кольриджа «Иней о древнем мореплавателецитировал: «Вода, вода повсюду, и ни капли для питья!» В этих знаменитых строках Кольридж показал, что у него нет воды для питья, несмотря на то, что он окружен океаном. Он также упомянул, что убил альбатроса (который, согласно местным преданиям, приносит несчастье всем на корабле). Конечно, своими знаменитыми строками он также подтверждает общеизвестный факт, что 75% поверхности Земли покрыто водой. Кроме того, мы также знаем, что 60% человеческого тела состоит из воды. Таким образом, вода (простая молекула) играет решающую роль во всех процессах.
Чтобы студенты больше узнали об этом известном явлении (подробно), преподаватели химии колледжей задают домашнее задание по химическим свойствам H2O, его структуре, экологическому значению и т. д., чтобы определить глубину их понимания. Однако студенты, не понимая химических свойств, структуры и общего значения, часто с трудом могут составить хорошо изученные и уникальные статьи в сжатые сроки. К счастью, несколько известных веб-сайтов с репетиторскими заданиями (например, ТопДомашнее заданиеПомощник) предлагает всестороннюю помощь в выполнении домашних заданий по химии как по базовым, так и по продвинутым темам.
Их индивидуальное обучение позволяет учащимся расширить свои знания по предметам/концепциям, улучшить навыки академического письма и подготовить доклады, достойные подачи, для получения отличных оценок. Вы можете попробовать это, если столкнетесь с аналогичными трудностями в понимании конкретных тем по химии, включенных в их учебную программу.
Тем не менее, ниже мы доходчиво объясняем все, что касается названия, чтобы помочь вам приступить к выполнению домашнего задания.
Химические свойства воды
Будучи химическим веществом, (H2O) реагирует со многими веществами, образуя различные химические соединения.
Окислительно-восстановительная реакция: Являясь прекрасным источником водорода (имея 2 атома водорода, ковалентно связанных с одним атомом кислорода), электроположительные элементы уменьшают количество молекул водорода.
Во время фотосинтеза H2O восстанавливается и окисляется до O2, что становится жизненно важным для окислительно-восстановительных реакций. (Просмотреть пример)
![]()
Атмосферный по своей природе: Многие, возможно, знают, что H2O может служить основанием и кислотой. Это указывает на то, что по своей природе он атмосферен. (Просмотреть пример)
Кислотное поведение:
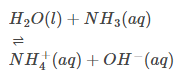
Основное поведение:
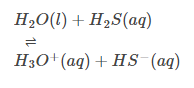 Реакция гидролиза: Он также имеет сильную склонность к гидратации, главным образом из-за своей диэлектрической проницаемости, и может растворять некоторые известные соединения. Некоторые ионные и ковалентные соединения могут подвергаться гидролизу.
Реакция гидролиза: Он также имеет сильную склонность к гидратации, главным образом из-за своей диэлектрической проницаемости, и может растворять некоторые известные соединения. Некоторые ионные и ковалентные соединения могут подвергаться гидролизу.
Безопасный помощь в выполнении домашних заданий в колледже на TopHomeworkHelper.com и получите бесплатный доступ к многочисленным решениям для ответов на вопросы химии и заметкам для написания заметок.
Подробнее о свойствах H2O
- Молярная масса – 8,01528(33) g/mol
- Плотность твердого вещества – 0,9167 г/мл при 0 °С.
- Плотность жидкости – 0,961893 г/мл при 95 °С, 0,9970474 г/мл при 25 °С, 0,9998396 г/мл при 0 °С.
- Температура плавления – 0 градусов Цельсия.
- Точка кипения – 100 градусов С.
- Кислотность – 13,995
- Давление пара – 0,032176 атм/3,1690 килопаскаль.
- Вязкость – 0,890 сП
- Теплопроводность –0,6065 Вт/м·К
- Индекс преломления – 1,3330 (nD)
- Основность – 13,995 (пКб)
Химия структуры воды
Химическая структура воды представляет собой два разных атома водорода, связанных с одним атомом кислорода. Из-за более высокой электроотрицательности атомов кислорода он имеет полярные ковалентные связи. Атом кислорода в большей степени, в отличие от атомов водорода, переманивает общие электроны ковалентных связей. Следовательно, атомы кислорода заряжаются отрицательно (частично), а атомы водорода получают частичный положительный заряд. Затем атомы принимают изогнутую структуру из-за двух неподеленных электронных пар на атоме кислорода. Изогнутая форма молекулы воды возникает из-за того, что полярные связи O – H не компенсируют друг друга, и вся молекула полярна.
Более того, полярные связи притягиваются друг к другу за счет диполь-дипольных сил (положительный конец одной молекулы притягивается к отрицательному концу соседней молекулы). В воде полярные связи O–H имеют небольшую электронную плотность вблизи атомов водорода, при этом каждый атом H2 притягивается к одиноким электронам соседнего атома O. Это называется водородными связями, и они сильнее любых обычных диполь-дипольных сил.
Экологическое значение
Учитывая, что население мира ежегодно растет, экологическая значимость и потребность в полезной воде также растут.
Вода также важна для питания, выращивания и ухода за различными растениями и животными (даже для перемещения и размножения рыб). Регулярный полив цветущих растений также обеспечивает пищу и убежище насекомым, рептилиям, лягушкам и млекопитающим. Даже лесные птицы хорошо реагируют на здоровые водно-болотные угодья. Они могут легко питаться и перемещаться для опыления растений и борьбы с насекомыми и вредителями.
Общественность должна признать ценность воды в большей степени. Чистая вода имеет решающее значение для сельского хозяйства, животноводства, санитарии и поддержания окружающей экосистемы. Вода помогает восстанавливать и поддерживать естественный сток в реках, водно-болотных угодьях, ручьях и т. д., а также поддерживает среду обитания в поймах.
Таким образом, для мирового правительства и других официальных органов, ответственных за поддержание здоровой, возобновляемой и устойчивой системы водоснабжения на благо каждого, важно.
Рекомендуемый источник изображения
Source: Химия воды: свойства, структура и экологическое значение.